Qu’un mélange aussi hétéroclite d’eau, d’alcali et de corps gras puisse donner naissance à une substance qui n’a plus rien à voir avec l’étonnante mixture de départ, c’est magique, n’est-ce pas ?
1. La réaction de saponification
Pourtant derrière chaque savon, se cache bel et bien une réaction chimique connue en langage courant sous le nom de saponification.
Elle consiste à hydrolyser, sous l’effet d’une base forte ou alcali, un ester en ion carboxylate et alcool. Comme vous pouvez l’entrevoir, cela va bien au delà d’une simple recette de cuisine dont le résultat se limite à la somme des ingrédients.

De par sa définition, on comprend aisément pourquoi en jargon chimique pur, elle est appelée « hydrolyse basique des esters » ou encore « hydrolyse des esters en milieu basique » … Oui mais… ester, ion carboxylate, alcool, hydrolyse basique… y a pas moyen de faire plus simple!…
Repartons des trois éléments fondamentaux qui permettent la fabrication du savon en ne nous concentrant que sur l’essentiel…
Les corps gras (beurres et huiles) font partie d’un ensemble complexe de composés organiques appelés lipides ou graisses caractérisés par leur insolubilité dans l’eau. Et ce qui nous intéresse ici, c’est qu’ils sont majoritairement composés de triglycérides autrement appelés « triester de glycérol » issus d’une molécule de glycérol et de trois acides gras comme reproduit dans le schéma ci-dessous:

Histoire de se simplifier la vie, on pourrait représenter la molécule de glycérol sous la forme d’un grand E où chacun des trois bras est constitué d’un groupe hydroxyle, représenté par le radical OH et correspondant à la fonction alcool et les acides gras (que nous verrons en détail en temps opportun), sous forme d’un petit train plus ou moins long dont chaque wagon représente un atome de carbone transportant un ou deux atomes d’hydrogène avec à sa tête une locomotive qui possède un groupe fonctionnel carboxyle, COOH, signant leur appartenance à la famille des acides carboxyliques. Autre notion importante à prendre en compte, ce sont des acides faibles car en solution, ils ne se dissocient que partiellement mais nous y reviendrons…
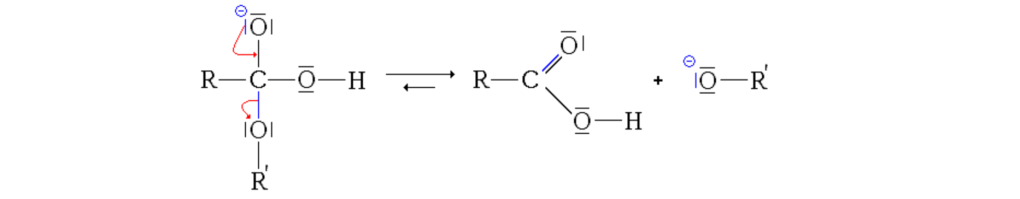
Lors de leur rencontre, deux ions d’hydrogène et un d’oxygène soit une molécule d’eau (H20) par acides gras concernés sont expulsés pour laisser place à une liaison ester. Cette réaction est appelée estérification.
A y regarder de près, on se rend compte que la réaction inverse est possible et permet de restituer les réactifs de départ. Cette réaction s’appelle l’hydrolyse des esters… Quel que soit le sens de la réaction, il n’y a pas de création de « nouvelles molécules »…
Viennent ensuite les alcalis… L’hydroxyde de sodium (soude caustique, NaOH) et l’hydroxyde de potassium (potasse caustique, KOH) appartiennent quant à eux à la famille des métaux alcalins.
Composés de l’ion sodium, Na+, (Natrium en latin) ou de l’ion potassium, K+, (Kalium en latin), ils sont reliés par une liaison d’une extrême instabilité à l’ion OH–.
Toujours prêt à partir au quart de tour, leur rencontre avec un liquide déclenche une réaction violente et exothermique (qui dégage de la chaleur) se soldant par une dissociation (ou ionisation) complète sous forme d’ions Na+ ou K+ et OH– qui les classent dans la famille des bases fortes. En faisant appel à la notion de pH, on peut qualifier la solution obtenue de basique ou alcaline.
Et enfin, l’eau (ou tout autre liquide) … Bien qu’elle n’apparaisse pas dans la réaction de saponification, on peut constater que son rôle est bien plus important qu’il n’y paraît puisque par la mise en solution de l’alcali, elle en permet la dissociation et déclenche ainsi le processus sous l’action de l’ion OH–.
Cette réaction chimique s’appelle l’hydrolyse basique des esters. Elle se déroule en trois temps:
Pour le coup, c’est nettement moins sorcier (du moins, je l’espère) et apporte tout son sens à la définition même de la saponification…
Réaction lente, complète (qui se déroule jusqu’à épuisement de l’un ou l’autre des constituants) et exothermique, elle aboutit à la formation:
– de molécules de savon appelées également sels sodiques ou potassiques d’acides carboxyliques, carboxylates de sodium ou de potassium ou encore sels métalliques alcalins.
– de glycérol, sous-produit de la réaction de saponification plus connu sous le nom commercial de glycérine qui en profite pour reprendre sa structure chimique de base,
– de quelques molécules d’eau qui assurent la cohésion de tout ce petit monde.
2. Structure et propriétés du savon
Il va sans dire qu’il y a sel et sel et ce qui fait toute la différence, ce sont bien sûr les réactifs utilisés. Partons d’un exemple simple, le sel de table (NaCl) pouvant être obtenu en faisant réagir de l’acide chlorhydrique avec de l’hydroxyde de sodium:
Bien que la même réaction chimique en soit à l’origine à savoir une simple neutralisation acido-basique, les produits en résultant dépendent de la nature même des réactifs de départ qui leur confèrent des propriétés particulières même si certaines peuvent être partagées.
Retournons à notre carboxylate… Résultat de la rencontre d’un acide faible et d’une base forte, sa formule chimique simplifiée peut s’écrire:

Et en chimie, là où traine un +, on y retrouve un –, et cela s’explique par le fait qu’un sel est un composé ionique constitué de cations chargés positivement et d’anions chargés négativement, réécrivons la formule en en tenant compte:
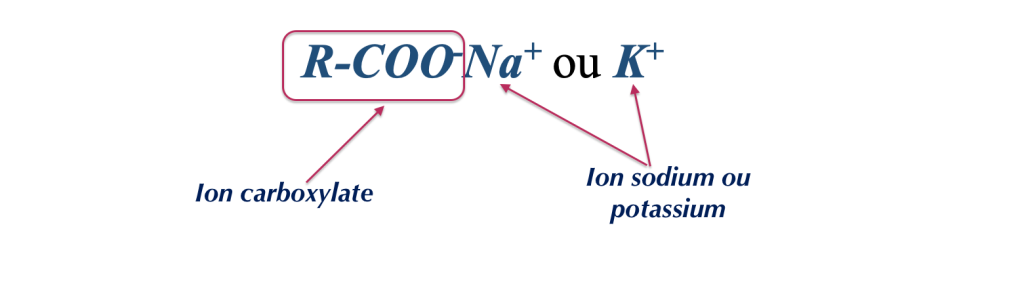
Ce qui nous permet enfin de découvrir l’ion carboxylate, responsable des propriétés du savon et qui, si vous avez quelques notions de chimie, est la base conjuguée de l’acide carboxylique dont il est issu.
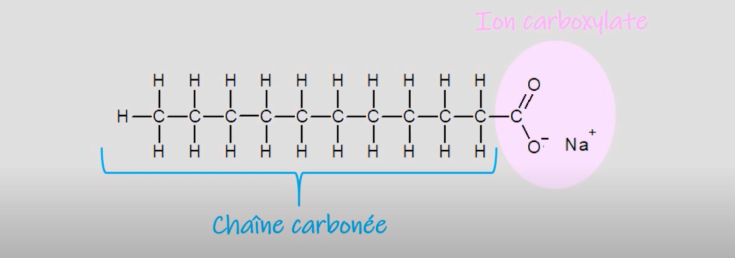
Libérée par la mise en solution du savon, cette étonnante molécule est composée de deux parties: d’une part, une chaine hydrocarbonée plus ou moins longue héritée de l’acide carboxylique parent et d’autre part, le radical COO–.

La chaine hydrocarbonée électriquement neutre (dite apolaire) constitue la « queue » de la molécule. Elle est lipophile c’est-à-dire qu’elle aime les graisses, par contre, elle n’a aucune affinité pour l’eau et est ainsi qualifiée d’hydrophobe.
Le groupement carboxylate, appelée « tête » possède une charge négative (dite polaire ou ionique) qui va lui permettre d’être attiré par l’eau et d’interagir avec elle. Il est donc hydrophile et par conséquent lipophobe.

Enfin, sachez que les composés à la fois attirés par les molécules d’eau et les molécules de graisse sont qualifiés d’amphiphiles et que cette particularité est le propre des tensioactifs…
J’en profite pour glisser une petite parenthèse concernant la terminologie des sels de savons… Pour obtenir le nom d’un ion carboxylate, il suffit de remplacer le suffixe -ique ou -oïque de l’acide carboxylique parent par -ate ou -oate et le tour est joué comme par exemple pour l’acide oléique qui après saponification devient de l’oléate de sodium ou de potassium et ainsi de suite pour les autres acides gras.
3. Le pouvoir lavant du savon
La force de frappe de notre bon savon est régit par un phénomène physico-chimique.
Tensioactif possédant une charge négative (COO–) qu’il libère en solution aqueuse, il appartient à la classe des anioniques. Il sert en quelque sorte de pont entre deux liquides non miscibles et permet lors de la friction de créer une émulsion par diminution de la tension superficielle à l’interface de l’autre liquide. La formation des bulles de savon répond au même phénomène et ici, c’est l’air qui joue le rôle de fluide apolaire. Mais ne vous y méprenez pas, la mousse ne nettoie pas… C’est juste un effet collatéral dû au phénomème physique de friction.
Par le caractère amphiphile de ses constituants, une fois mélangé à l’eau, le savon va pouvoir jouer son rôle de détergent grâce à la formation de micelles qui emprisonnent les corps gras qui seront ensuite évacués lors du rinçage.

Le savon est un produit « nettoyant ». Par nature, ses molécules sont « asséchantes » puisqu’elles entraînent avec elles une plus ou moins grosse partie du film hydrolipidique protecteur de la peau. Il ne peut donc pas être « hydratant » car il lui est impossible de remplir deux fonctions diamétralement opposées en même temps!!!!… Un savon, ça lave et c’est tout ce qu’on lui demande…
Mais, il est bien sûr possible d’en diminuer la détergence en privilégiant des acides gras qui apportent de la douceur, en choisissant un taux de surgraissage adapté à la formulation et au type de peau et enfin, ne négligeons pas le rôle humectant du glycérol naturellement produit lors du processus de saponification et l’ajout de certains additifs. Tout cela contribuera à le rendre moins agressif et permettra un renouvellement plus rapide du film hydrolipidique…
Il est à noter également que la qualité de l’eau aura une influence sur le pouvoir nettoyant et moussant du savon. Caractérisée par une teneur plus ou moins élevée en ions calcium et magnésium, une eau dure aura des répercussions négatives sur ses performances. (voir: « Un remède à l’écume de savon »). Cela s’explique par le fait que ses ions chargés positivement vont accaparer les ions carboxylates et les précipiter. Ce qui en diminue la disponibilité et contribue à en minimiser la détergence.
Il en est de même pour ses performances en eau salée dans laquelle il n’arrive pas à se dissoudre puisque les molécules d’eau ont déjà fort à faire avec l’ion sodium. Voilà ce qui explique pourquoi un savon ne mousse pas dans l’eau de mer puisqu’elle est à la fois salée et dure de par la présence de nombreux minéraux.
Il y a toutefois une exception à cette règle, un savon formulé à base d’huile de coco dont l’acide gras majoritaire est l’acide laurique. Composé de 12 atomes de carbone, il a la particularité d’être beaucoup plus soluble que ses cousins à longues chaines carbonées, ce qui lui permet de produire de la mousse même dans l’eau de mer et explique son haut niveau de détergence. (voir: « Pourquoi certains acides gras en excès dans une formulation assèchent-ils la peau? »)
Enfin sachez qu’un savon ne fonctionne que parce que son pH est basique!… Qu’il soit proche de la neutralité et qu’il puisse continuer de remplir la fonction qui lui a été assignée est chimiquement impossible…
Nous voici arrivés au terme de ce long chapitre théorique. N’hésitez pas à consulter les nombreuses autres pages. Comme toujours, je reste disponible pour toute interrogation en suspens…
Bullez bien… Soyez prudents et prenez soin de vous…
Bibliographie:
Amphiphile: https://fr.wikipedia.org/wiki/Amphiphile
Comment le savon lave-t-il ?: https://www.futura-sciences.com/sciences/questions-reponses/chimie-savon-lave-t-il-6335/#
De l’eau douce à l’eau salée: http://soniag.chez.com/experience/eau3.html
Estérification – Hydrolyse – Saponification: https://tice.ac-montpellier.fr/ABCDORGA/Famille/ESTEYDRO.html
Estérification , hydrolyse et réaction de saponification (hydrolyse basique) : https://chimiephysiquescience.wordpress.com/2021/03/21/esterification-hydrolyse-et-reaction-de-saponification/
Glycérol: https://fr.wikipedia.org/wiki/Glycérol
Glycérol : qu’est-ce que c’est ?: https://www.futura-sciences.com/sciences/definitions/chimie-glycerol-3534/
La constante de basicité sur https://www.alloprof.qc.ca/fr/eleves/bv/chimie/la-constante-de-basicite-kb-c1061
La mousse du savon: https://www.chimix.com/ifrance/devoirs/t062.htm
La neutralisation acidobasique: https://www.alloprof.qc.ca/fr/eleves/bv/sciences/la-neutralisation-acidobasique-s1068
Le Savon : Découvrez comment et pourquoi le savon lave !: https://www.biotyfullbox.fr/cosmetique-bio/actualite-bio/savon/
Les sels: https://www.nagwa.com/fr/explainers/706159237273/
Propriétés du savon: https://dlatreyte.github.io/premieres-pc/chap-12/4-proprietes-savons/
Saponification: the process of making soap: https://www.olabs.edu.in/?brch=3&cnt=1&sim=119&sub=73
Saponification: https://fr.wikipedia.org/wiki/Saponification#:~:text=La%20saponification%20est%2C%20dans%20le,permet%20la%20synthèse%20du%20savon.
Savons: propriétés, applications et illustrations: https://www.maxicours.com/se/cours/savons-proprietes-applications-et-illustrations/#:~:text=Les%20ions%20carboxylate%20interagissent%20avec,ce%20qui%20permet%20leur%20élimination.
Transformer les réactions chimiques: https://www.superprof.fr/ressources/scolaire/physique-chimie/terminale-s/transformations-ester-chimie.html
Kevin M.Dunn, Scientific Soapmaking: The Chemistry of the Cold Process, Clavicula Press; Illustrated edition (March 16, 2010)







Très jolie explications, je suis en formation pour la fabrication de savons a froid je trouve que c’est la meilleure méthode pour avoir des savons de qualité.
J’aimeJ’aime
Merci Sami…
J’aimeJ’aime
Bonjour,
J’aimerais profiter de votre incroyable expertise. Vous êtes tellement généreuse, c’est fabuleux, merci à l’avance.
Je me question à savoir
1-d’où viens le diiode dans le savon?
[Ma question viens du fait que je le vois dans les calculs de dureté mais pas dans la soude ni dans les triglycérides. ]
2- où s’en va le cation sodium au cours de la saponification ?
[ Je comprend que OH- se lie au chaines chaines carbonées et que la glycérine se retrouve libre. Mais oups, je perd le fil du Na+.]
Merci de bien vouloir considérer mes interrogations.
J’aimeJ’aime
Bonjour Myriam,
C’est moi qui vous remercie pour votre passage sur mon modeste blog et votre commentaire…
Je ne suis ni physicienne ni chimiste mais même si la saponification s’apparente à de l’art, elle est avant tout une réaction chimique. Il va de soi qu’il y a des bases et fondements théoriques qui la régissent et la conditionnent sans parler des différents facteurs qui en influenceront sa réalisation.
Face à un savon raté, la faute à pas de chance n’existe pas… Toute erreur se paie…
Pour répondre à votre première question, il est utile de se rappeler que les corps gras sont constitués de différents acides gras que l’on répertorient en trois catégories en fonction du nombre d’insaturation qu’ils contiennent :
– Les acides gras saturés qui n’ont aucune insaturation sur leur chaine carbonnée.
– Les acides gras mono-insaturés qui en ont une (acide oléique).
– Les acides gras poly-insaturés qui eux en ont deux (acide linoléique) ou trois (acide linolénique).
Ce qui va conditionner la stabilité des différents corps gras et leur potentiel oxydatif car plus il y aura d’insaturation et plus l’huile sera sensible au rancissement. Un excellent dossier à consulter sur AromaZone…
https://www.aroma-zone.com/info/dossier-thematique/le-potentiel-oxydatif-des-huiles-vegetales
Ce potentiel oxydatif est donné par l’indice d’iode qui correspond à la masse d’halogène exprimée en grammes, calculée en I2 fixé sur les doubles liaisons de 100g de corps gras et permet donc de déterminer le degré d’insaturation d’un corps gras.
Cet indice est calculé en laboratoire, pour ce qui est de la méthode, voici le lien : https://tice.ac-montpellier.fr/ABCDORGA/Famille/Tp/TP60.html
J’en viens au cation sodium… La réaction de saponification des corps gras produit du glycérol et un mélange de carboxylates soit de sodium qui a pour formule RCOO –, Na+ (savons durs), soit de potassium, RCOO –, K+(savons mous ou liquides). Elle se déroule en trois étapes et voici un lien à suivre pour plus de précision : http://www.lyc-mendesfrance-vitrolles.ac-aix-marseille.fr/spip/sites/www.lyc-mendesfrance-vitrolles/spip/IMG/pdf/Le_savon_pdf.pdf
Et à y regarder de près sur la liste INCI (Nomenclature internationale des ingrédients cosmétiques) de savons saponifiés à froid : sodium oléate pour l’huile d’olive saponifiée, sodium cocoate pour l’huile de coco, sodium shea butterate pour le beurre de karité, etc…
N’hésitez pas à me recontacter pour toutes demandes particulières…
Cordialement.
Marie
J’aimeJ’aime
Humble blogue ? Le mot est faible. Votre blogue est fantastique, vos publications autant que tous les commentaires enrichissants. Tout est bien structuré et l’information est fondée sur des faits. Il y a certes beaucoup de travail, de recherche, de temps et d’expérience derrière tout ça. BRAVO et merci de ce généreux partage.
Merci pour votre réponses tres détaillées qui répond à merveille à ma curiosité. Elle m’a insisté à ressortir un vieux bouquin de chimie organique oublié. J’ai maintenant, grâce à vous une bonne compréhension globale. ENFIN !
La toute dernière chose qui reste en suspend pour moi à présent, ça concerne la glycérine. Peut-être pouvez vous m’orienter à nouveau?
A mon humble connaissance(à rectifier s’il y a lieu je vous prie), la glycérine peut absorber environ 10 fois son poids en eau, tel une éponge. Lorsque non saturée, elle aurait donc le potentiel d’aspirer l’eau des profondeurs de la peau et donc de déshydrater cette dernière.
Comment explique-t-on alors les propriétés humectantes de la glycérine du savon SAF?
La glycérine serait saturée et formerait une barrière ? ou est-ce une synergie avec le surgras laissé sur la peau?…. ou est-ce que j’ai tout faux ?😆
Un très sincère et immense merci à l’avance. Marie.
J’aimeJ’aime
Bonjour Myriam,
Merci… Merci… Merci…
S’il est vrai que la glycérine peut retenir jusqu’à 10% de son poids en eau et qu’en cosmétique, il n’est pas recommandé de la doser à plus de 10% car elle aurait alors un effet asséchant, pourquoi dit-on qu’un savon saponifié de façon artisanal est l’excellence pour la peau ?..
Pour répondre à la question (sans entrer dans trop de détails), il faut prendre en compte d’une part le film hydrolipidique de la peau et d’autre part, le mécanisme d’action des molécules de savon.
Notre épiderme est recouvert d’un film protecteur constitué de lipides produits par les glandes sébacées, de ciment intercellulaire, de sueur, d’eau et de facteurs naturels d’hydratation, sans cesse renouvelé, qui la préserve des multiples agressions extérieures.
A y regarder de très près, le savon est lui constitué de molécules tout en longueur. Il y a une extrémité ronde formée par le groupement carboxylate, appelée « tête » qui est hydrophile et lipophobe et l’autre extrémité où l’on retrouve la chaine hydrocarbonée constituant la « queue » de la molécule qui elle, est hydrophobe et lipophile.
Une fois mélangée à l’eau, les molécules de savon à la fois hydrophiles et lipophiles vont capturés les graisses et la saleté qui seront ensuite évacuées par l’eau. Cet action est donc « asséchante » puisqu’elle entraîne avec elle une plus ou moins grosse partie de ce film protecteur.
Et donc, de par le surgraissage, c’est-à-dire les acides gras non saponifiés et son contenu en glycérol naturellement produit lors de la saponification, ce type de savon contribuera à la préservation et reconstitution du film hydrolipidique… Simply as that…
Au plaisir de vous retrouver pour d’autres grands débats…
Cordialement.
Marie
J’aimeJ’aime
Merci pour ce site ! Vous nous avez beaucoup aidé pour un projet !
J’aimeJ’aime
Bonjour Kerean,
C’est moi qui vous remercie pour votre passage sur le blog… S’il reste des questions en suspens, n’hésitez pas, je me ferais un plaisir de vous répondre…
Cordialement
Marie
J’aimeJ’aime
Merci de votre explication
J’aimeJ’aime