Unités de base des lipides, les acides gras dont on parle tant en nutrition sont des composés organiques issus de l’association de molécules de carbone, d’hydrogène et d’oxygène. Rarement seul, on les rencontre principalement sous forme d’esters dans les corps gras tant d’origine végétale qu’animale. Transformés en ions carboxylates par la réaction de saponification, ce sont eux « les véritables architectes » de votre futur savon…
1. Structure des acides gras
A l’état naturel, à nombre pair d’au minimum quatre atomes de carbone, les plus importants et représentatifs sur lesquels on se basera en saponification en comptent entre douze et dix-huit. Leur structure est constituée à l’une des extrémités par le groupement fonctionnel carboxyle -COOH, caractéristique de la famille des acides carboxyliques et à l’autre, par un groupement méthyle -CH3. Leur formule chimique générique simplifiée s’écrit R-COOH.

Par facilité, on pourrait les illustrer par un petit train comportant une série plus ou moins longue de wagons correspondant chacun à un atome de carbone, représentant ainsi la chaine hydrocarbonée (le R de la formule) avec à sa tête une locomotive caractérisée par le groupe carboxylique -COOH, le composant acide leur permettant d’interagir dans de nombreuses réactions chimiques.

Soit deux régions bien distinctes à l’origine du caractère amphipathique de ces molécules: « la tête » hydrophile qui interagit avec l’eau dite polaire et « la queue » hydrophobe, non polaire, qui la repousse et ainsi justifie leur insolubilité dans l’eau.
2. Classification des acides gras
Notamment responsable de l’état sous lequel un corps gras se présente à température ambiante, les acides gras se différencient d’une part par leur longueur de chaine carbonée qui en permet une première classification (courte, moyenne, longue) mais aussi par la présence ou l’absence d’atomes d’hydrogène qui modifie le type de liaison entre les atomes de carbone à l’origine de l’infinie variété des composés moléculaires de chimie organique dont les unités de base sont les atomes liés les uns aux autres par l’intermédiaire d’une liaison chimique formant une entité électriquement neutre.
Appelée covalente ou de covalence, cette liaison chimique est le résultat de la mise en commun d’un certain nombre d’électrons chargés négativement dits de valence gravitant sur la couche externe (ou couche de valence) des différents atomes que j’ai tenté de représenter succinctement dans le schéma ci-dessous sur base des électrons de valence de l’atome de carbone (4) et d’hydrogène (1) :

Si l’on transfère ce que nous venons de voir à la chaine carbonée d’une molécule d’acide gras, chaque atome de carbone partagera avec ses congénères deux électrons de valence pour créer une liaison covalente entre eux et le reste servira à se lier aux atomes d’hydrogène disponibles. Si jamais une paire d’atomes d’hydrogène venait à manquer, pour assurer la neutralité de la molécule, deux atomes de carbone consécutifs mettront alors en commun leur électron célibataire pour créer une deuxième liaison entre eux. Appelée double liaison., elle a pour but de combler le vide laissé par le déficit en atomes d’hydrogène. La présence ou l’absence de ces doubles liaisons permet de les classifier en deux grandes familles: les acides gras saturés et les acides gras insaturés.

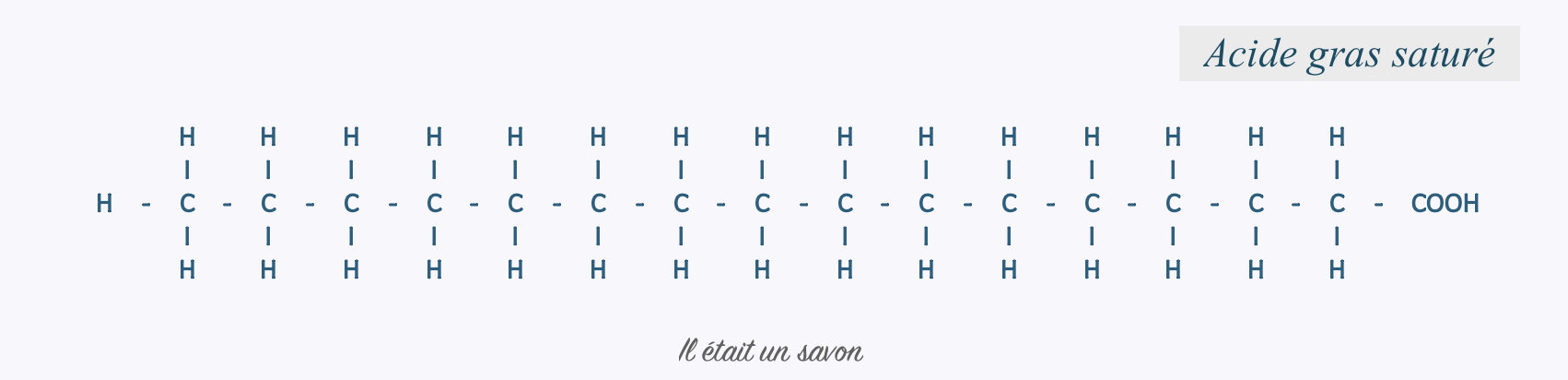
A. Les acides gras saturés
Présents en quantité variable dans tout type de corps gras, la chaine carbonée des acides gras saturés ne présente aucun déficit en atomes d’hydrogène. Elle est dite saturée et leur formule générale simplifiée s’écrit CnH2nO2.
Le plus petit représentant de la famille est l’acide butyrique à quatre atomes de carbone (C4H8O2). Il se retrouve dans le beurre, le ghee et d’autres dérivés d’origine animale. Les plus fréquents sont l’acide laurique à douze atomes de carbone, l’acide palmitique et l’acide stéarique qui respectivement en comptent seize et dix-huit.
S’il est dit qu’ils se présentent sous forme solide à température ambiante, une petite nuance doit cependant être apportée. Le meilleur exemple nous est fourni par l’huile de coco fractionnée également connue sous le nom de « caprylis ». Obtenue par hydrolyse et fractionnement de l’huile de coco, elle est majoritairement composée de triglycérides d’acide caprilique, un acide gras saturé à huit atomes de carbone qui se présente sous forme liquide à température ambiante. Les acides gras saturés ne seront en définitive solides à température ambiante que s’ils comptent aux minimum dix atomes de carbone.
B. Les acides gras insaturés
Les acides gras insaturés se distinguent par la présence de doubles liaisons entre les atomes de carbone. A l’état naturel (exception faite pour les dérivés laitiers, les graisses et la viande des ruminants), les atomes d’hydrogène portés par les atomes de carbone de la double liaison se situent du même côté. Cette configuration appelée « cis » a pour conséquence d’en modifier la structure spatiale. Provoquant des courbures au sein de la chaine carbonée, ils seront moins souples et plus difficiles à « ranger » que les acides gras saturés, raison pour laquelle ils se présentent sous forme liquide à température ambiante.
En cas de configuration dite « trans » pouvant apparaître lors du procédé d’hydrogénation partielle, les atomes d’hydrogène se positionnant de part et d’autre de la chaine carbonée, cette dernière prendra alors une forme rectiligne et un comportement similaire à celle d’un acide gras saturé.

Leur formule générale simplifiée s’écrit CnH2n-2xO2. Unique ou multiple, le nombre d’insaturations permet de les classifier en deux sous-catégories.
a. Les acides gras monoinsaturés
Ne présentant qu’une seule double liaison, le chef de file de ce groupe est l’acide oléique à dix-huit atomes de carbone.

On peut également citer l’acide palmitoléique à seize atomes de carbone présent en quantité non négligeable dans l’huile de macadamia mais aussi l’acide ricinoléique, acide gras majoritaire de l’huile de ricin.
b. Les acides gras polyinsaturés
Porteurs de plusieurs insaturations, les plus abondants comptent dix-huit atomes de carbone. On y retrouve l’acide linoléique à deux doubles liaisons, acide gras majoritaire de l’huile de pépins de raisin ou encore de tournesol ainsi que l’acide linolénique à trois doubles liaisons, acide gras dominant de l’huile de lin par exemple.

A noter que la position des éventuelles doubles liaisons suit un schéma bien précis. Elles se disposent en alternance avec un carbone lié à deux atomes d’hydrogène soit espacée de trois atomes de carbone.

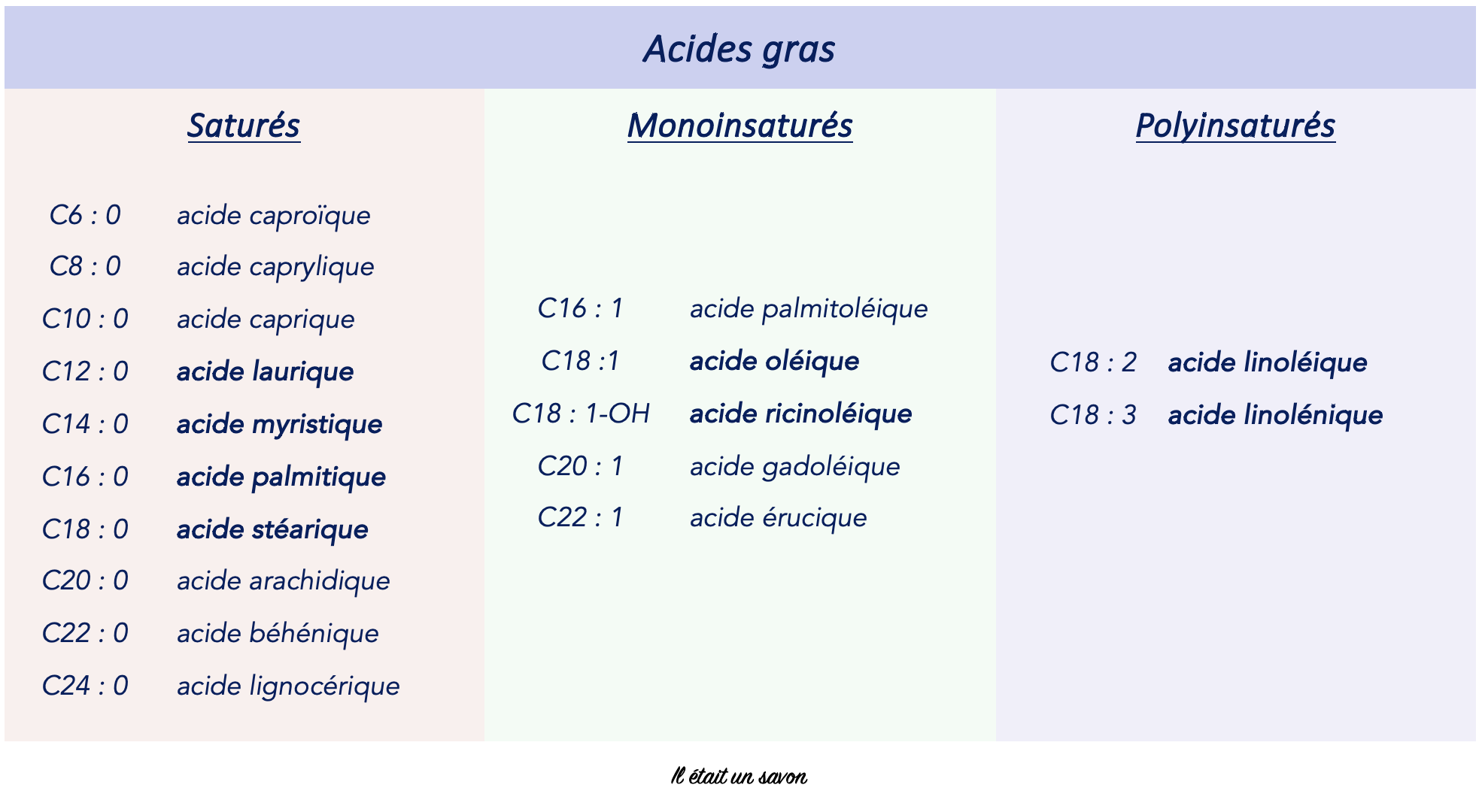
3. Nomenclature des acides gras
Outre le petit nom usuel dérivé de leur découverte, les acides gras peuvent être désignés de manière abrégée par deux nombres séparés par deux points. Le premier renseigne sur la quantité d’atome de carbone de la molécule et le deuxième sur l’absence de doubles liaisons (0) ou leur présence (de 1 à x).
Et on pourrait très bien sans trop se casser la tête en rester là… Mais à coup sûr, vous avez déjà entendu parler de la classification oméga des acides gras insaturés notamment utilisée par les nutritionnistes qui coexiste mais diffère diamétralement de celle des chimistes.
Dans la nomenclature conventionnelle normalisée de chimie organique (IUPAC – Union Internationale de Chimie Pure et Appliquée), la position du carbone des éventuelles doubles liaisons est déterminée à partir du carbone du groupement réactif carboxyle -COOH noté 1 (ou delta 1). Appelée nomenclature delta, chaque double liaison y est renseignée par un chiffre. Une méthode d’identification alternative existe aussi et consiste à attribuer une lettre de l’alphabet grec aux autres atomes de carbone. Le deuxième s’appellera alpha, le troisième, bêta et le dernier, celui du groupement méthyle, oméga, en référence à la dernière lettre de l’alphabet grec. Reprise par l’ancienne nomenclature abrégée oméga, ce dernier carbone devient le carbone 1 et le comptage se fait donc à contre-sens.

Destinée à mettre en avant la fonction physiologique des acides gras particuliers, cette numérotation abrégée a été corrigée pour permettre de repérer la position des doubles liaisons quelle que soit la longueur de chaine carbonée. On la retrouve maintenant sous forme de « n – x » où le n représente le nombre d’atomes de carbone et le x correspond à la position de la première (ou unique) double liaison au départ du carbone du méthyle terminal.

Et pour terminer ce paragraphe, je vous propose un petit récapitulatif des deux nomenclatures au départ d’acides gras ayant en commun, une chaine carbonée de dix-huit atomes de carbone.

4. Propriétés physico-chimiques des acides gras
a. Propriétés physiques
Température à laquelle un acide gras existe sous forme liquide, le point de fusion (ou température de fonte) sera dépendant de la longueur de chaine carbonée et de la présence de doubles liaisons. Jusqu’à huit atomes de carbone, les acides gras saturés seront liquides à température ambiante. Au delà, au plus la chaine carbonée est longue, au plus la température de fonte s’élève. A même longueur de chaine carbonée, la présence de doubles liaisons la diminue. Ce qui signifie que le point de fusion sera d’autant plus élevé que l’acide gras est long et saturé.
La deuxième, la solubilité, liée au caractère lipophile et apolaire de la chaine carbonée qui pour rappel constitue la « queue » de la molécule, varie selon les deux mêmes paramètres. Les acides gras à quatre et six atomes de carbone sont solubles dans l’eau. Au-delà, plus la chaine carbonée s’allonge, plus la partie hydrophobe s’impose, ce qui en diminue la solubilité. La présence de doubles liaisons augmente le caractère polaire et l’améliore. En résumé, les acides gras seront d’autant moins solubles qu’ils sont saturés et longs.
b. Propriétés chimiques
Elles sont liées d’une part au groupement carboxyle -COOH, le composant justifiant leur appartenance au groupe des acides, qui leur permet de participer aux réactions de saponification et d’estérification déjà décrites dans « La chimie du savon » et d’autre part, inhérente à la présence de doubles liaisons dans la chaine carbonée n’impliquant que les acides gras insaturés dans des réaction dites d’addition dont le fameux phénomème d’oxydation d’une importance capitale en saponification.
Responsable d’une odeur de rance et d’un changement d’aspect, l’oxydation des acides gras insaturés avec une nette prédominance pour les polyinsaturés par attaque de la double liaison peut être engendrée ou accélérée de différentes façons. Les principaux facteurs naturels sont l’oxygène de l’air, la lumière, la chaleur mais aussi la présence de certains pigments comme la chlorophylle par exemple ou encore certains métaux comme le cuivre et le fer. Certains traitements lors de leur fabrication peuvent également en être responsables comme la pression à chaud, le procédé d’hydrogénation et bien d’autres encore…
Ce qui nous amène à parler de l’hydrogénation. Consistant à ajouter chimiquement des molécules d’hydrogène (dihydrogène – H2) aux acides gras polyinsaturés, ce procédé industriel permet d’éliminer partiellement ou totalement les doubles liaisons entre les atomes de carbone responsables du rancissement des huiles végétales et en améliore ainsi la conservation. Mise au point à la fin du 19ème siècle, c’est le principe de base de fabrication des margarines qui rend les huiles liquides, semi-solides ou solides à température ambiante. Les modifications structurelles apportées aux acides gras initiaux par suppression des doubles liaisons sera dépendante du stade d’avancement du processus à savoir total ou partiel.
Procédé d’obtention de nombreuses cires végétales utilisées notamment pour la fabrication de bougies, l’hydrogénation totale des huiles conduit à la formation d’acides gras saturés. On retiendra ici la cire de soja dont la saturation de tous les acides gras insaturés à dix-huit atomes de carbone de l’huile végétale par l’ajout de molécules d’hydrogène amène à la production d’un composant très riche en acide stéarique qui justifie non seulement son changement d’aspect à température ambiante mais également l’augmentation de sa température de fonte et qui en fait un parfait substitut si l’on ne veut pas employé celui issu de l’huile de palme. On peut également ranger dans cette catégorie, la fameuse « Végétaline » couramment utilisée en saponification. Obtenue par hydrogénation totale d’huile de coprah, ici aussi, le peu d’acides gras insaturés qu’elle contenait est converti en acides gras saturés et sa composition diffère donc d’une huile de coprah classique qualifiée de raffinée.
Décriée pour ses effets néfastes sur la santé humaine, l’hydrogénation partielle, quant à elle, ne supprime pas toutes les doubles liaisons et a la fâcheuse réputation de conduire à la formation d’acides gras de configuration « trans ». Matières grasses utilisées par les industriels du secteur alimentaire, ces mauvais acides gras se retrouvent dans les produits finis qu’il est fortement conseillé de consommer avec modération… Ce qui était sensé clore le paragraphe au vu du peu d’intérêt en matière de saponification…
Mais après avoir lu récemment dans un livre traitant du sujet que la majorité des huiles alimentaires vendues en grande distribution était des « huiles hydrogénées » (???), je me suis demandée d’où pouvait bien sortir cette surprenante vérité alors que la disponibilité de ces matières grasses se limite pour les petits consommateurs aux margarines et aux huiles de friture semi-solides composées de mélange d’huiles impossible à utiliser pour réaliser ses savons puisque l’on n’en connait ni la répartition exacte ni l’indice de saponification!!!… Et au final, n’a t’on pas confondu raffinage et hydrogénation?…
5. Influence des acides gras sur le processus de saponification
Pour comprendre le pourquoi et le comment des choses, il est important de prendre en considération que la saponification est une réaction chimique conditionnée par la nature des différents intervenants et de certains paramètres pouvant en influencer le déroulement. Il faut arrêter de penser que la soude caustique est mystérieuse, capricieuse, qu’elle bouffe tout, n’en fait qu’à sa tête ou encore choisit ce qu’elle va saponifier en premier ou pas du tout.
Le deuxième souci majeur est de considérer tout corps gras comme une simple entité unique et indissociable alors qu’il s’agit d’un assemblage moléculaire majoritairement composé d’un mélange de triglycérides d’acides gras. Le solde résultant de leur combinaison sera juste un mélange « différent » de triglycérides d’acides gras où il sera impossible de les distinguer individuellement. Et pour ceux qui doute encore du bien-fondé de la démarche, demandez-vous ce que l’on obtient en rajoutant de l’eau du robinet à une demi carafe d’eau minérale…
Parler savon ne signifie donc pas penser huiles, graisses ou beurres, ce ne sont jamais que des termes génériques servant à les qualifier, mais bien acides gras car ce sont eux les valeureux fantassins qui donneront naissance aux différentes molécules de savon et qui, en fonction de tout ce que l’on vient de voir, saponifieront plus ou moins vite.
Cela étant, corroborée par les expériences menées par les élèves du Dr Kevin M. Dunn sur la validité du surgraissage à la trace (« Superfatting and the Lye Discount ») et la structure propre de chacun où la présence de doubles liaisons constitue un handicap par la complexité ajoutée à leur configuration spatiale, on peut dire que les acides gras saturés saponifient plus vite que les acides gras monoinsaturés, eux même plus rapides que les acides gras polyinsaturés, les petits derniers de la classe, exception faite pour l’acide ricinoléique.
Bien qu’il appartienne à la famille des monoinsaturés, ce « Speedy Gonzales » toute catégorie possède un groupement particulier qui explique son étonnant comportement. Acide gras inhabituel et spécifique de l’huile de ricin, il se distingue des autres par la présence sur la chaine carbonée d’une ramification hydroxyle -OH, soit une fonction alcool qui en améliore les performances.
Toutefois, entre la théorie et la pratique, il y a parfois tout un monde de différence. Pour faire simple, on ne parle jamais que de triglycérides. Pourtant, en fonction des conditions d’extraction, de la qualité des matières premières et des conditions de stockage, certains acides gras peuvent ne pas être liés à une molécule de glycérol ou si les huiles végétales ne sont plus de prime fraîcheur, s’en sont libérés par simple mécanisme d’hydrolyse (voir « La chimie du savon »). Voyageant en solitaire, il est possible qu’ils soient les premiers participants à la réaction de saponification et ce, quelle que soit la famille d’acides gras à laquelle ils appartiennent provoquant la survenue d’une trace éclair inexpliquée.
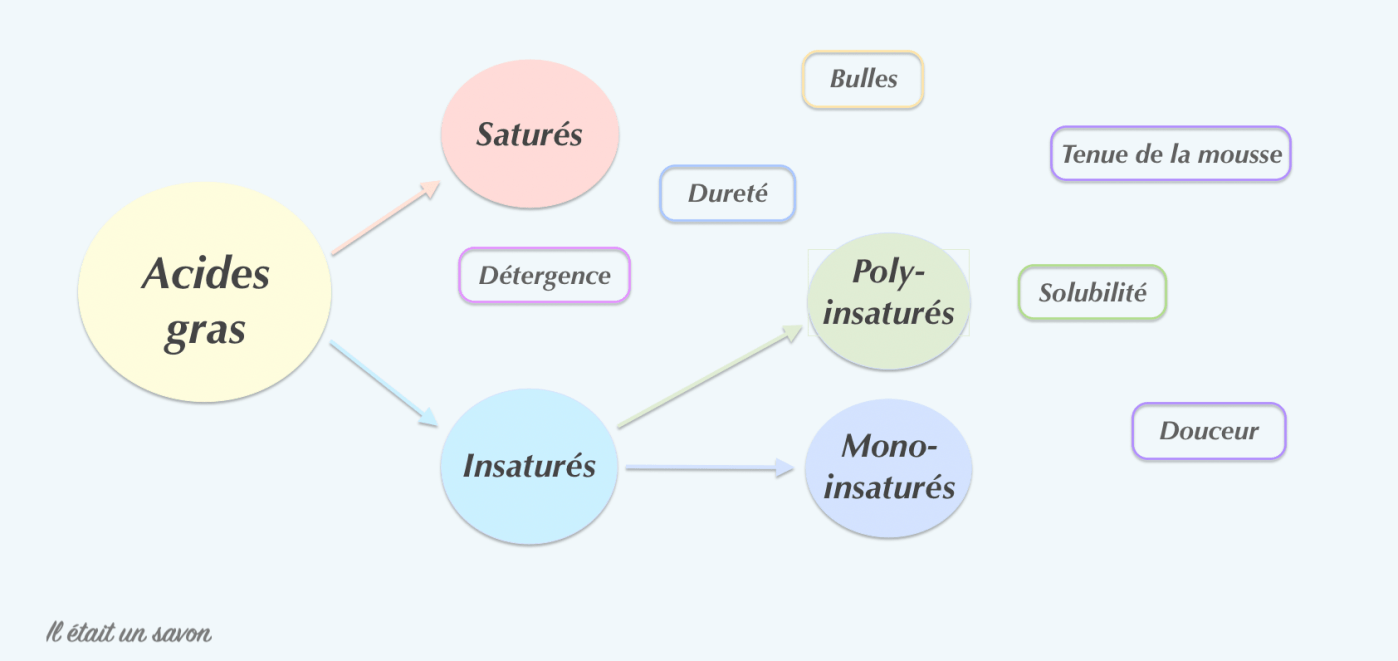
6. Caractéristiques conférées au savon solide
On en arrive à coup sûr à ce qui vous intéresse le plus et si vous n’avez sauté aucun paragraphe, les réponses s’imposent d’elles-mêmes et n’intéressent que les savons obtenus avec de la soude caustique, cela s’entend. Hormis pour la sensibilité à l’oxydation qui n’implique que les acides gras insaturés, les autres caractéristiques seront toutes conditionnées par les propriétés chimiques des différents acides gras.
Le point de fusion (ou température de fonte) permet de déterminer la dureté du savon obtenu. Principalement dictée par les acides gras saturés et dans une moindre mesure par les monoinsaturés, elle est proportionnelle à la longueur de chaine de carbonée. Ainsi, l’acide stéarique à dix-huit atomes de carbone qui a un point de fusion au environ de 69°C apportera plus de dureté au savon que l’acide laurique à douze atomes de carbone qui lui se situe au environ de 43°C.
La solubilité quant à elle influencera le pouvoir lavant du savon et donc dans la foulée, la douceur mais aussi la taille des bulles, la texture de la mousse fournie et la vitesse de fonte. Les acides gras les plus solubles sont les acides laurique et myristique, les seuls à fournir de vraies bulles non persistantes. Cette haute solubilité est responsable de leur « agressivité », raison pour laquelle il est recommandé de les limiter. Inversement proportionnelle au pouvant lavant, la douceur du savon augmentera avec la longueur de chaine carbonée et la présence de doubles liaisons. Les plus doux sont les acides gras polyinsaturés linoléique et linolénique qu’il faudra néanmoins limiter car saponifiant moins vite que les autres, ils risquent de se retrouver en quantité non négligeable dans le surgras et pourraient être responsables d’un rancissement plus ou moins prématuré du savon. La texture crémeuse et la tenue de la mousse sont principalement attribuées aux acides gras saturés les moins solubles, les acides palmitique et stéarique et en moindre mesure aux acides gras insaturés avec une mention spéciale pour l’acide ricinoléique qualifié de booster.
Et pour terminer ce long chapitre, quoi de mieux qu’un petit résumé téléchargeable également en fichier PDF ici…

En complément, n’hésitez pas à consulter la page consacrée aux corps gras, vous pourrez y télécharger un fichier PDF donnant un aperçu des propriétés conférées au savon par quelques corps gras d’origine végétale sur base de leur répartition moyenne en acides gras.
Comme toujours, je reste disponible pour toute interrogation en suspens… Bullez bien… Soyez prudents et prenez soin de vous…
Bibliographie:
Kevin M. Dunn, « Scientific Soapmaking », Clavicule Press, 2010
Cuvelier C., Cabaraux J.-F., Dufrasne I., Hornick J.-L., Istasse L., Acides gras : nomenclature et sources alimentaires: http://www.facmv.ulg.ac.be/amv/articles/2004_148_3_03.pdf
Pr. Labbani, biochimie végétale, chapitre 2: https://fac.umc.edu.dz/snv/faculte/becol/2022/Pr-LABBANI-Lipides-Cours.pdf
Acides gras – Définition, structure, types, fonctions: https://microbiologynote.com/fr/fatty-acid-definition-structure-types-functions/
Acides gras saturés et acides gras trans: https://vandemoortele.com/fr-be/Que-sont-les-graisses-ou-huiles-hydrog%C3%A9n%C3%A9es
Biochimie structurale: http://christelle.larcher.free.fr/acides_gras.pdf
Composition, classement et rôle des huiles végétales: https://www.perles-gascogne.com/passeport-sante/2017/09/huiles-vegetales
Document de synthèse sur les acides gras trans: https://www.health.belgium.be/sites/default/files/uploads/fields/fpshealth_theme_file/acide_trans_synthese_final.pdf
Hydrogénation de la matière grasse: https://biochim-agro.univ-lille.fr/lipides/co/Cours_C_2.html
Huile hydrogénée ou partiellement: https://alimentation.pagesjaunes.fr/comprendre/huile-hydrogenee
Les acides gras: https://www.afblum.be/bioafb/acidgras/acidgras.htm
Les acides gras sont-ils polaires?: https://fr.lambdageeks.com/is-fatty-acid-polar/
Les lipides: structure et propriétés des acides gras: https://univ.ency-education.com/uploads/1/3/1/0/13102001/bioch1an-acides_gras2017belkacem.pdf
La structure de la matière: http://www2.ggl.ulaval.ca/personnel/bourque/s2/str.matiere.html#:~:text=L%27atome%20consiste%20en%20un,%C3%A9lectrons%20ayant%20une%20masse%20n%C3%A9gligeable.
Principaux constituants des lipides: https://www.cerin.org/wp-content/uploads/2012/12/132-133-principaux-constituants.pdf
Structure de l’atome: https://www.lyceedadultes.fr/sitepedagogique/documents/PC/PC2S/florian_poisson/Chapitre_3_Structure_atome.pdf
Tout savoir sur liaison covalente et représentation de Lewis: https://www.superprof.fr/ressources/physique-chimie/physique-chimie-1ere-s/liaison-lewis.html
IUPAC, molécule: https://goldbook.iupac.org/terms/view/M04002


Laisser un commentaire